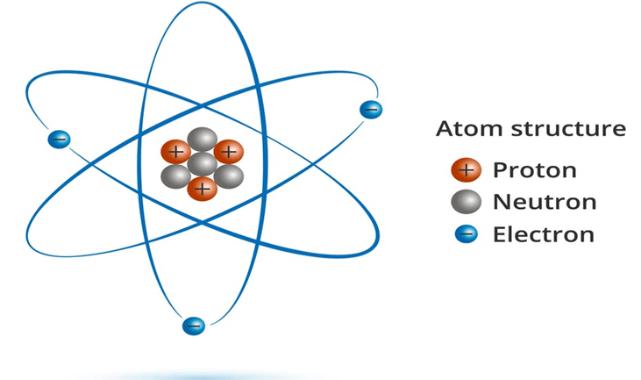
Atomlar, maddeyi oluşturan en küçük yapı taşlarıdır ve tüm elementlerin kimyasal özelliklerini belirler.
Atom yapısı, bir elementin kimyasal davranışlarını anlamak için son derece önemlidir. Periyodik tablo ise, elementlerin özelliklerini düzenli bir şekilde sınıflandırarak kimyanın temel taşlarını oluşturur. Bu makalede, atomun yapısını, atom teorisinin tarihsel gelişimini ve periyodik tablonun evrimini ele alacağız. Ayrıca, atom altı parçacıkların keşfi ve modern periyodik tablonun nasıl şekillendiği hakkında detaylı bilgi vereceğiz.
1. Atomun Yapısı
Atomlar, protonlar, nötronlar ve elektronlardan oluşan temel yapılar olarak bilinir. Atomun merkezi, pozitif yüklü protonlar ve yüksüz nötronlardan oluşan çekirdektir. Çekirdeğin etrafında ise negatif yüklü elektronlar bulunur. Elektronlar, enerji seviyeleri veya yörüngeler olarak adlandırılan bölgelerde hareket eder.
1.1 Protonlar, Nötronlar ve Elektronlar
Protonlar: Protonlar, pozitif yüklü parçacıklardır ve atomun çekirdeğinde bulunurlar. Bir elementin atom numarasını belirleyen proton sayısıdır. Örneğin, hidrojen atomu bir proton içerirken, oksijen atomu sekiz proton içerir.
Nötronlar: Nötronlar, yüksüz parçacıklardır ve protonlarla birlikte atom çekirdeğinde yer alırlar. Nötron sayısı, bir elementin izotoplarını belirler. Aynı elementin farklı izotopları, farklı sayıda nötron içerir.
Elektronlar: Elektronlar, negatif yüklü parçacıklardır ve çekirdek etrafında enerji seviyelerinde dönerler. Elektronlar, atomun kimyasal özelliklerini belirler. Elektronların sayısı, bir atomun nötr olup olmadığını belirler. Nötr bir atomda, proton sayısı ile elektron sayısı eşittir.
1.2 Enerji Seviyeleri ve Elektron Dizilimi
Elektronlar, atom çekirdeği etrafındaki enerji seviyelerinde bulunurlar. Bu seviyeler, çekirdekten uzaklıklarına göre düzenlenir ve her seviyede belli sayıda elektron bulunabilir. İlk enerji seviyesi maksimum iki, ikinci enerji seviyesi maksimum sekiz elektron alabilir. Atomların kimyasal özellikleri, en dış enerji seviyesindeki elektronlar, yani "değerlik elektronları" ile belirlenir. Değerlik elektronları, atomların nasıl bağlar kurduğunu ve kimyasal tepkimelerde nasıl davrandığını belirler.
1.3 İzotoplar
Bir elementin atomları, proton sayısı sabit kalmak koşuluyla farklı sayıda nötron içerebilir. Bu atomlara "izotop" denir. Örneğin, karbon elementinin iki izotopu vardır: Karbon-12 ve Karbon-14. Bu izotoplar, farklı nötron sayısına sahip olmalarına rağmen aynı kimyasal özellikleri gösterirler, ancak fiziksel özelliklerinde ve kararlılıklarındaki farklılıklar nedeniyle bazı durumlarda farklı davranışlar sergileyebilirler.
2. Atom Teorisi: Tarihsel Gelişim
Atom teorisi, maddenin doğasını açıklamak için geliştirilen bir dizi bilimsel hipotez ve deney sonucunda evrilmiştir. Atomun yapısı ve doğası hakkında ilk fikirler Antik Yunan filozoflarına kadar uzanır, ancak modern atom teorisi, bilimsel gözlem ve deneylerle geliştirilmiştir.
2.1 Democritus ve Antik Atom Fikri
Atom kelimesi, Yunanca "bölünemez" anlamına gelen "atomos" kelimesinden türemiştir. MÖ 5. yüzyılda, Yunan filozof Democritus, maddenin en küçük ve bölünemez parçalardan oluştuğunu öne sürmüştür. Ona göre, bu atomlar sürekli hareket halindeydi ve farklı kombinasyonlar oluşturarak maddeleri meydana getiriyordu. Ancak bu fikir, uzun yıllar boyunca bilimsel bir temele oturtulamadı.
2.2 Dalton Atom Modeli
1803 yılında John Dalton, modern atom teorisinin temellerini atan bir model ortaya koydu. Dalton'a göre, elementler küçük ve bölünemez atomlardan oluşur. Her elementin atomu benzersizdir ve farklı elementlerin atomları farklı kütlelere sahiptir. Dalton, atomların sabit oranlarda birleşerek bileşikleri oluşturduğunu öne sürmüştür. Bu, kimyasal tepkimelerin anlaşılmasında büyük bir adımdı.
2.3 Thomson ve Elektronun Keşfi
1897 yılında J.J. Thomson, atomun bölünebilir olduğunu ve negatif yüklü elektronların atomun bir parçası olduğunu keşfetti. Thomson, "üzümlü kek modeli" olarak bilinen bir atom modeli önerdi. Bu modele göre, atom, pozitif yüklü bir bulutun içine dağılmış negatif yüklü elektronlardan oluşuyordu. Ancak bu model, daha sonraki deneylerle geçerliliğini yitirdi.
2.4 Rutherford ve Çekirdek Modeli
1911 yılında Ernest Rutherford, atomun çoğunlukla boşluktan oluştuğunu ve pozitif yüklü protonların küçük, yoğun bir çekirdek içinde toplandığını öne sürdü. Rutherford'un altın levha deneyi, atom çekirdeğinin varlığını kanıtladı ve bu model, atomun yapısının daha doğru bir şekilde anlaşılmasını sağladı.
2.5 Bohr Atom Modeli
1913 yılında Niels Bohr, Rutherford'un modelini geliştirerek elektronların çekirdek etrafında belirli yörüngelerde döndüğünü ve bu yörüngelerdeki enerjinin kuantize olduğunu öne sürdü. Bohr modeli, hidrojen atomunun spektrumunu başarıyla açıklayabilmiş ve atomun enerji seviyeleri hakkında önemli bilgiler sunmuştur. Ancak bu model, daha karmaşık atomlar için geçerliliğini yitirmiştir.
2.6 Modern Kuantum Mekaniği ve Elektron Bulutu Modeli
Modern atom teorisi, kuantum mekaniği üzerine kuruludur. Heisenberg'in belirsizlik ilkesi ve Schrödinger'in dalga mekaniği denklemi, atomun yapısının daha doğru bir şekilde anlaşılmasını sağlamıştır. Elektronlar, kesin yörüngeler yerine, çekirdek etrafında "olası yerlerde" bulunur. Bu yerler, "elektron bulutu" olarak adlandırılır ve elektronların yerlerini tam olarak belirlemek imkansızdır.
3. Periyodik Tablo: Düzen ve Mantık
Periyodik tablo, elementlerin artan atom numarasına göre sıralandığı ve benzer kimyasal özellikler gösteren elementlerin gruplar halinde dizildiği bir tablodur. Bu düzenleme, elementlerin atomik yapıları ve elektron dizilimlerine dayanır.
3.1 Periyodik Tablonun Tarihi Gelişimi
Periyodik tablonun modern versiyonu, Rus kimyager Dmitri Mendeleev tarafından 1869 yılında oluşturulmuştur. Mendeleev, elementleri atom ağırlıklarına göre sıralamış ve benzer özellikler gösteren elementleri aynı gruplara yerleştirmiştir. İlginç bir şekilde, Mendeleev bazı elementlerin henüz keşfedilmediğini tahmin ederek tabloda boşluklar bırakmış ve bu elementlerin özelliklerini öngörmüştür. Daha sonra, Moseley'in atom numarası kavramını geliştirmesiyle periyodik tablo bugünkü halini almıştır.
3.2 Periyodik Yasa ve Grup Özellikleri
Periyodik yasa, elementlerin kimyasal özelliklerinin atom numarasına göre periyodik olarak tekrarlandığını belirtir. Periyodik tabloda dikey sütunlar "gruplar" ve yatay sıralar "periyotlar" olarak adlandırılır. Aynı gruptaki elementler, benzer kimyasal özellikler gösterir çünkü aynı sayıda değerlik elektronuna sahiptirler. Örneğin, alkali metaller (grup 1) oldukça reaktif elementlerdir ve benzer özellikler sergilerler.
3.3 Periyodik Tablo Grupları
Periyodik tablo, elementleri çeşitli gruplar halinde düzenler. Bazı önemli gruplar şunlardır:
Alkali metaller (1. grup): Hidrojen hariç, bu grup elementleri oldukça reaktiftir ve sulu çözeltilerinde hidroksit iyonları oluşturur.
Toprak alkali metaller (2. grup): Alkali metallere göre daha az reaktif olmalarına rağmen yine de reaktiftirler.
Geçiş metalleri (3-12. gruplar): Bu elementler, birden fazla oksidasyon durumuna sahip olabilir ve çeşitli endüstriyel uygulamalarda kullanılır.
Halojenler (17. grup): Bu elementler oldukça reaktiftir ve genellikle tuz bileşikleri oluşturur.
Soy gazlar (18. grup): Bu grup elementleri, en dış enerji seviyeleri dolu olduğu için kimyasal olarak inerttir.
3.4 Modern Periyodik Tablo ve Atomik Yapı
Modern periyodik tablo, elementlerin artan atom numarasına göre sıralandığı ve elektron dizilimlerine dayandığı bir tablodur. Her element, proton sayısına göre sıralanır ve elementlerin kimyasal özellikleri, değerlik elektronlarının sayısına bağlıdır. Periyodik tablo, atomların yapısını ve kimyasal özelliklerini anlama konusunda büyük bir rehberdir ve kimya biliminde hayati bir araçtır.
Atom yapısı ve periyodik tablo, kimyanın temel yapı taşlarını oluşturur. Atomun yapısının anlaşılması, kimyasal tepkimelerin ve elementlerin özelliklerinin daha iyi kavranmasını sağlar. Periyodik tablo, elementler arasındaki ilişkileri düzenler ve kimyanın temel kurallarını açıklar. Atom teorisinin tarihsel gelişimi ve periyodik tablonun evrimi, bilimin ilerlemesini ve doğanın temel prensiplerinin keşfini simgeler.